研究紹介
ゲノム医科学による自己免疫疾患の統合的理解と臨床応用
アレルギー・リウマチ内科では、免疫の異常が関係する疾患を対象に研究を行っています。疾患としては関節リウマチや膠原病に代表される自己免疫疾患、気管支喘息や食物アレルギーなどのアレルギー性疾患を専門としています。微生物や腫瘍などの異物に対して、それを攻撃し除去するのが正常な免疫システムですが、自己免疫疾患では、自己に対して過剰な免疫応答が起こり、臓器障害をきたすことが知られています。自己免疫疾患に対する治療としては、ステロイドを中心とした全般的な免疫抑制療法による治療が現在でも主流であり、副作用の問題は解決すべき大きな課題です。また自己免疫疾患の多くは難病の範疇に入る疾患であり、更なる研究と、その成果を患者さんに還元する努力が求められています。当科では、ゲノム医科学による自己免疫疾患の統合的理解とその臨床応用についての研究を行っており、その取り組みについて紹介します。
1.ゲノム医科学による自己免疫疾患の統合的理解
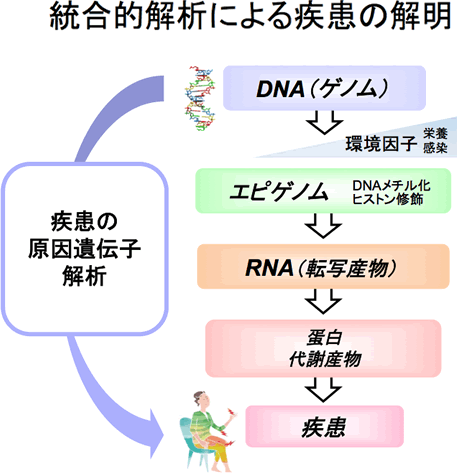 大規模なゲノムワイド関連解析の進展により、関節リウマチ、全身性エリテマトーデス(SLE)などをはじめとした自己免疫疾患の遺伝的背景が明らかとなってきました。興味深いことに、これらのリスク遺伝子には免疫に関連する遺伝子が多く含まれており、自己免疫疾患の病態理解が大きく進みました。一方で、リスク遺伝子を有することが、どのように病気の発症につながるのかという点については未だに理解は不十分で、今後の大きな課題となっています。当科では、膠原病患者さんにご協力いただくことで、リンパ球を中心とした免疫担当細胞の割合やエピゲノムの状態、遺伝子発現が健常人とどのように異なるか、また特定の病態と関連しているかについて、次世代シークエンサーを用いて網羅的に解析しています。そして、疾患リスク遺伝子が免疫細胞でどのような異常を起こし、病気の発症に関与しているかといった病因・病態の統合的理解を進めることで、新規創薬・個別化医療の可能性についての検討を進めています。例えば、"ある膠原病において、Xという免疫担当細胞におけるYというパスウェイの亢進が特徴的な場合、X, Yに対する標的療法が極めて有効である可能性がある"、といった内容の理解が進みつつあるところです(図1)。このような理解を通して、研究から臨床・個別化医療への還元を視野に入れた活動をめざしています。
大規模なゲノムワイド関連解析の進展により、関節リウマチ、全身性エリテマトーデス(SLE)などをはじめとした自己免疫疾患の遺伝的背景が明らかとなってきました。興味深いことに、これらのリスク遺伝子には免疫に関連する遺伝子が多く含まれており、自己免疫疾患の病態理解が大きく進みました。一方で、リスク遺伝子を有することが、どのように病気の発症につながるのかという点については未だに理解は不十分で、今後の大きな課題となっています。当科では、膠原病患者さんにご協力いただくことで、リンパ球を中心とした免疫担当細胞の割合やエピゲノムの状態、遺伝子発現が健常人とどのように異なるか、また特定の病態と関連しているかについて、次世代シークエンサーを用いて網羅的に解析しています。そして、疾患リスク遺伝子が免疫細胞でどのような異常を起こし、病気の発症に関与しているかといった病因・病態の統合的理解を進めることで、新規創薬・個別化医療の可能性についての検討を進めています。例えば、"ある膠原病において、Xという免疫担当細胞におけるYというパスウェイの亢進が特徴的な場合、X, Yに対する標的療法が極めて有効である可能性がある"、といった内容の理解が進みつつあるところです(図1)。このような理解を通して、研究から臨床・個別化医療への還元を視野に入れた活動をめざしています。
2.ImmuNexUTデータベースを活用した研究展開
 自己免疫疾患では様々なレベルで免疫システムに異常が起きますが、どの免疫細胞のどの遺伝子やパスウェイが疾患発症に重要かは良く分かっていません。そこで当科では、自己免疫疾患の統合的理解に向け、ご同意をいただいた400例を超える患者さん・健常ボランティアの方々にご協力をいただき、血液検体から28種類に及ぶ免疫細胞を分取して、それぞれの遺伝子発現量を次世代シーケンサーで定量した大規模な免疫データベースを構築しました(Immune Cell Gene Expression Atlas from the University of Tokyo;ImmuNexUT )(文献1)。これは世界で初めての大規模な疾患免疫データベースで、網羅的なヒト免疫システムの理解への重要なリソースになると考えられます。
自己免疫疾患では様々なレベルで免疫システムに異常が起きますが、どの免疫細胞のどの遺伝子やパスウェイが疾患発症に重要かは良く分かっていません。そこで当科では、自己免疫疾患の統合的理解に向け、ご同意をいただいた400例を超える患者さん・健常ボランティアの方々にご協力をいただき、血液検体から28種類に及ぶ免疫細胞を分取して、それぞれの遺伝子発現量を次世代シーケンサーで定量した大規模な免疫データベースを構築しました(Immune Cell Gene Expression Atlas from the University of Tokyo;ImmuNexUT )(文献1)。これは世界で初めての大規模な疾患免疫データベースで、網羅的なヒト免疫システムの理解への重要なリソースになると考えられます。
当科では本データベースを用いて遺伝子多型の機能を解析する事で、様々な免疫疾患の発症に関わる遺伝子多型が、どの免疫細胞でどの遺伝子の発現を変化させるのかを明らかにしました。また、疾患状態において遺伝子多型の機能がダイナミックに変化する事を見出しました(文献1)。
この様に本データベースを活用する事で、ゲノム研究で明らかになった遺伝的リスク(ゲノムの個性)を、遺伝子や細胞種といった治療介入可能なレベルにつなげていく事が可能となります(図2)。より一般的には、我々の免疫の個人差がどのようにゲノムにより形作られているかをひも解く事ができるようになります。
膠原病は疾患間のみならず疾患内での多様性が大きいのが特徴です。我々の免疫データベースを用いることでその多様性を捉える事ができることから、当科では患者さん由来のビッグ・データを精緻に解析し、免疫プロファイルによる疾患の再分類、治療抵抗性に関わる因子の同定、疾患特異的な免疫異常の同定など様々な観点から自己免疫疾患の解明に向けた研究を進めています。最終的には、新規治療標的の同定や、患者さんの病態に併せた治療戦略の構築(「個別化医療」の実現(後述))につなげていきたいと考えています。
研究内容詳細:東京大学プレスリリース
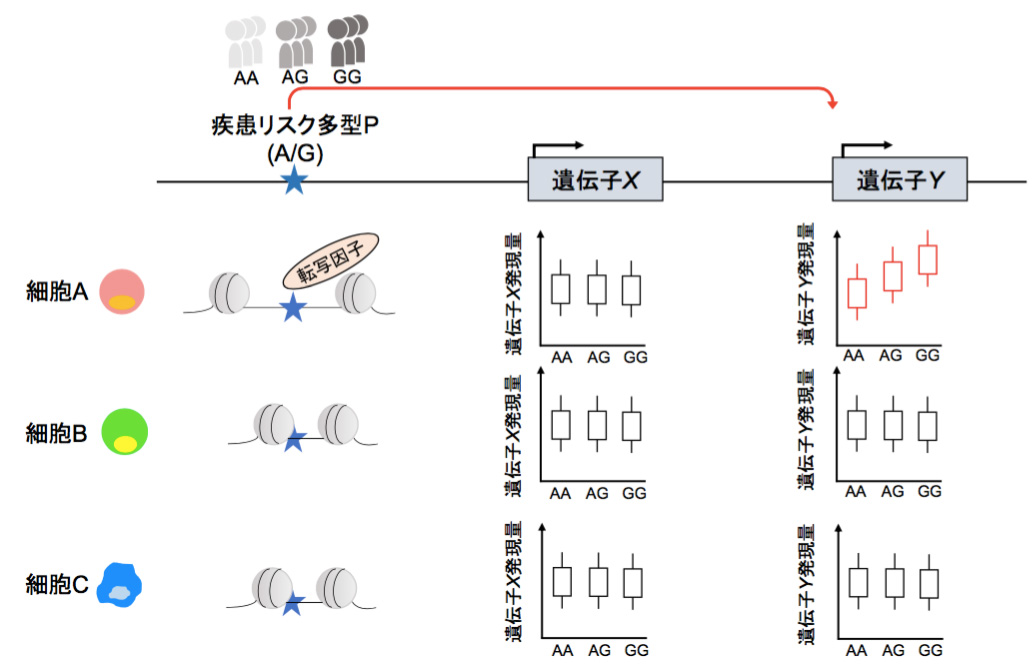
図2: ImmuNexUTデータベースを用いる事で、ゲノムワイド関連解析(GWAS)で同定された疾患リスク多型Pが、細胞Aにおける遺伝子Yの発現量の個人差を生む事が分かる。
3.自己免疫の制御に関わる新たな加齢関連T細胞
自己免疫疾患は、免疫という本来は身体を守る仕組みに異常が起こり、自分の組織を攻撃してしまう病気です。その発症には遺伝的および環境的な要因が関与しますが、自己免疫疾患の多くが中年以降に発症のピークを迎えることから、「加齢」も重要な要因として知られています。また、免疫学的な細胞レベルでの老化が、自己免疫疾患の発症に関わっているとも考えられています。
当科では、加齢で増加するT細胞を発見し、「ThA(Age-associated helper T/加齢関連ヘルパーT)細胞」と命名し報告しました(文献2)。詳細な解析を行ったところ、ThA(ティー エイチ エー)細胞は、若年齢の自己免疫疾患でも増加し、その細胞は健康な方のThA細胞とは性質が異なっていました。
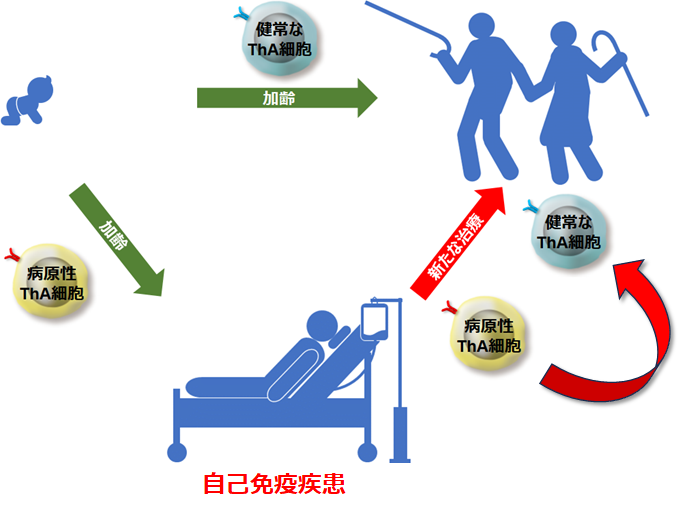
図3: 加齢により増加するThA細胞と新規治療の可能性
ThA細胞の機能を調べたところ、これまでは別々の細胞が担うと考えられていた、抗体産生を導く機能と、周囲の細胞を傷害する機能の2つを併せ持っていることが分かりました。加齢で増加し、かつこれら2つの機能を持つ細胞は、世界で初めての発見となります。
代表的な自己免疫疾患として、全身性エリテマトーデス(SLE)が知られています。SLEは、自分に対する抗体である様々な自己抗体が産生され、全身の臓器の障害を認める疾患であり、難病に指定されています。ThA細胞は若年齢のSLE症例でも増加しており、健康な方と比べB細胞の抗体産生を促進させる分子を、非常に高く産生していることが分かりました。また、他のT細胞と比較して、ThA細胞の遺伝子発現の違いが、SLEの病気の勢いを最も強く反映していることが分かりました。
本研究では、ThA細胞のこれら2つの機能は、ZEB2という遺伝子で制御されているということの特定にも成功しました。
これらの知見は、ThA細胞が、自己免疫応答と健康長寿の違いを知ることができる重要な細胞であることを示唆しており、自己免疫疾患の新たな治療法開発、健康長寿社会実現への展開が期待されます。
研究内容詳細:東京大学プレスリリース NHK NEWS WEB 東京大学学術機関レポジトリ
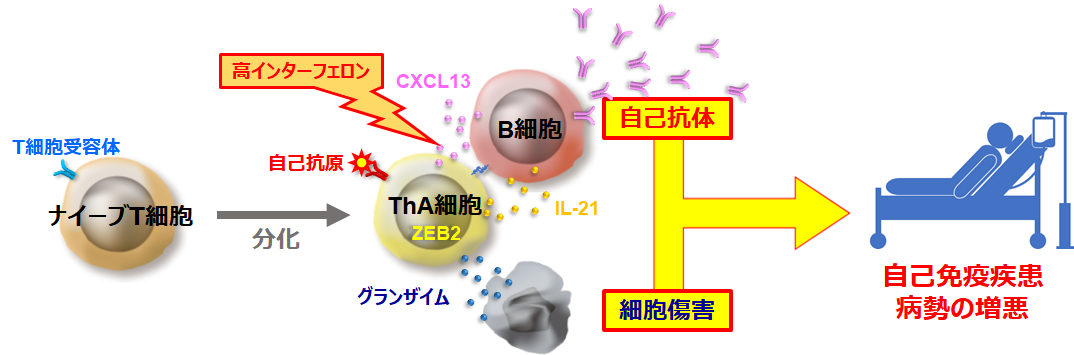
図4:ThA細胞による自己免疫疾患制御メカニズムの概念図
ThA細胞は、B細胞からの抗体産生の促進と、細胞を傷害するという機能を併せ持っている。ThA細胞はT細胞受容体を介して、自己の成分である自己抗原などを特異的に認識して活性化することが想定される。細胞傷害は、グランザイム(タンパク分解酵素の一種)などを介して発揮される。活性化したThA細胞は、IL-21およびCXCL13を分泌してB細胞の抗体産生を促進する。この作用は、SLEなどの病気を悪化させることが知られているインターフェロンαというサイトカインの濃度が体の中で高い時に、より強くなると考えられる。自己免疫疾患においては、ThA細胞を介した作用により、臓器が障害される一方、健康な高齢者では、この作用が感染症の防御などに向けられることが想定される。
4.自己免疫を抑える新しい免疫担当細胞
全身の免疫学的恒常性は、多種の免疫担当細胞が協調することで保たれています。免疫応答の中心を担うT細胞は、炎症を促進するものと、炎症を抑制するものに分かれます。このバランスが崩れることは自己免疫疾患の発症に繋がると考えられています。後者は「制御性T細胞:regulatory T cell (以下 Treg (ティーレグ)」と呼ばれ、燃え上がった自己免疫反応を鎮静化する能力がある細胞として近年注目されています。
Tregは胸腺の中で分化するものと、胸腺を出てから分化するものに大別されます。これらのTregはそれぞれ体の中の守備範囲が異なると考えられています。前者(図5の緑色の細胞)は、細胞表面にCD25という目印になる分子を出していて、Foxp3という遺伝子がその働きに重要であることが発見されたことを機に、世界中で研究が行われるようになりました。一方、後者のTregは存在することは知られていましたが、目印となる細胞表面のマーカーとその働きに重要な遺伝子が長年不明なままであり、研究が遅れていました。
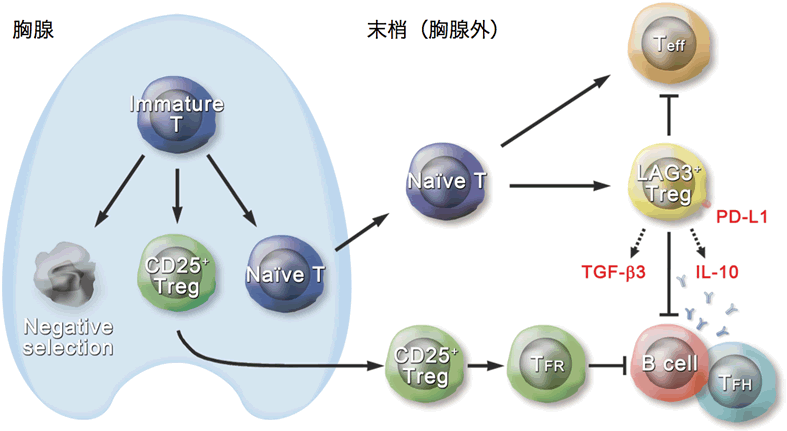
図5:制御性T細胞による免疫制御の概念図(文献7より引用)
当科では世界で初めて、胸腺を出てから分化するTregの目印がLAG3であること、またその機能に重要な遺伝子がEgr2であることを発見し報告しました(文献3)。EGR2遺伝子は、SLEの発症に関わる遺伝子(疾患感受性遺伝子)でもあります(文献4)。この細胞を我々はLAG3 Treg (ラグスリー ティーレグ)と命名しました(図5の黄色の細胞)。LAG3 Tregは、IL-10およびTGF-β3といったサイトカインを分泌して過剰となったT細胞およびB細胞による炎症を強力に抑制します(文献5, 6)。
自己免疫を抑える薬の開発は生命予後を大きく改善しましたが、一方で全身の免疫を抑えてしまうことから感染症など重大な副作用を引き起こすことが問題ともなっています。Tregは自らの持つ受容体で抑えるべき対象を絞り込む能力があることから、理想的な治療法に繋がる可能性を内包していると考えられています。
4.これからの医療に必要なものは?
現代の医療は、病名に対応する薬剤を医師の経験を元に治療に用いることが主流ですが、これからの医療は個々人にとって最適な医療、すなわち「個別化医療」の実現が求められています。その為には、現在捉えられている病気の概念を新しい視点から捉えなおす必要があります(図6)。
「新しい視点」とは今まで治療に活用されてこなかった「新しい情報」を意味します。新しい病気の分類とは、同じ病名であっても体の中で起こっている異常の違いを見出すことであり、最も奏効率の高い治療法の選択だけでなく、新しい治療法の開発にも繋がる可能性を意味しています。
このような研究には、患者さんのご協力と、免疫学的実験手法の確立、遺伝子解析に関する高度な統計学的解析手法の開発が必要となります。当科は2018年4月から社会連携講座として「免疫疾患機能ゲノム学講座」(特任准教授:岡村僚久、特任助教:永渕泰雄、太田峰人)を設立いたしました。同講座と当科は密接に連携し、臨床上での問題点既存の概念に縛られない新しい発想から、次世代の治療に繋がる研究に取り組んでいます。
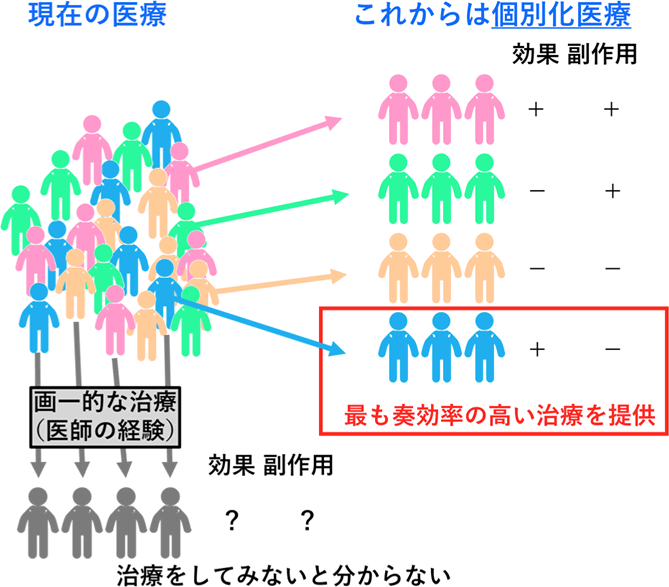
図6:個々人に最適な「個別化医療」とは
文献
- Ota M, Nagafuchi Y, Hatano H, Ishigaki K, Terao C, Takeshima Y, Yanaoka H, Kobayashi S, Okubo M, Shirai H, Sugimori Y, Maeda J, Nakano M, Yamada S, Yoshida R, Tsuchiya H, Tsuchida Y, Akizuki S, Yoshifuji H, Ohmura K, Mimori T, Yoshida K, Kurosaka D, Okada M, Setoguchi K, Kaneko H, Ban N, Yabuki N, Matsuki K, Mutoh H, Oyama S, Okazaki M, Tsunoda H, Iwasaki Y, Sumitomo S, Shoda H, Kochi Y, Okada Y, Yamamoto K, Okamura T, Fujio K. Dynamic landscape of immune cell-specific gene regulation in immune-mediated diseases. Cell. 2021;184(11):3006-3021.e17.
- Goto M*, Takahashi H*, Yoshida R*, Itamiya T, Nakano M, Nagafuchi Y, Harada H, Shimizu T, Maeda M, Kubota A, Toda T, Hatano H, Sugimori Y, Kawahata K, Yamamoto K, Shoda H, Ishigaki K, Ota M#, Okamura T#, Fujio K#. Age-associated CD4+ T cells with B cell-promoting functions are regulated by ZEB2 in autoimmunity. Science Immunology 2024; DOI:10.1126/sciimmunol.adk1643, URL:https://www.science.org/doi/10.1126/sciimmunol.adk1643
- Okamura T, Fujio K, Shibuya M, Sumitomo S, Shoda H, Sakaguchi S, Yamamoto K. CD4+CD25-LAG3+ regulatory T cells controlled by the transcription factor Egr-2. Proc Natl Acad Sci U S A. 2009; 106(33):13974-9.
- Myouzen K, Kochi Y, Shimane K, Fujio K, Okamura T, Okada Y, Suzuki A, Atsumi T, Ito S, Takada K, Mimori A, Ikegawa S, Yamada R, Nakamura Y, Yamamoto K. Regulatory polymorphisms in EGR2 are associated with susceptibility to systemic lupus erythematosus. Hum Mol Genet. 2010; 19(11):2313-20.
- Okamura T, Sumitomo S, Morita K, Iwasaki Y, Inoue M, Nakachi S, Komai T, Shoda H, Miyazaki J, Fujio K, Yamamoto K. TGF-beta3-expressing CD4+CD25-LAG3+ regulatory T cells control humoral immune responses. Nature Communications, 2015; 6:6329. pp. 1 – 14.
- Morita K, Okamura T, Inoue M, Komai T, Teruya S, Iwasaki Y, Sumitomo S, Shoda H, Yamamoto K, Fujio K. Egr2 and Egr3 in regulatory T cells cooperatively control systemic autoimmunity through Ltbp3-mediated TGF-β3 production. Proc Natl Acad Sci U S A. 2016; 113(50):E8131-E8140
- Okamura T, Yamamoto K, Fujio K. Front Immunol. 2018; 26;9:340.
 東京大学医学部附属病院
東京大学医学部附属病院