疾患解説
関節リウマチ(Rheumatoid arthritis: RA)
1.疾患概念と疫学
関節リウマチとは、持続する滑膜炎をきたす自己免疫性の全身性炎症性疾患で、炎症の持続により軟骨の破壊、骨びらんが生じることが特徴である。有病率は 0.5〜0.8%程度とされ、10代〜90代のどの年代でも発症しうる。男女比 1:4 とされているが、高齢発症例では男女差は目立たなくなる。原因については、関節リウマチは遺伝的な要因と、環境的な要因が合わさりあって発症に至る疾患と考えられている。遺伝的な要因については、HLA-DR多型が代表的かつ寄与率が最も高く、非HLA遺伝子についてもPADI4, CCR6, TNFAIP3など免疫に関連する遺伝子の重要性がいわれている。環境的要因としては、喫煙の関与、腸内細菌などの関与が知られている。遺伝的背景をもった個体に、なんらかの環境要因の影響があることで、免疫学的な異常を生じるとされている。発症数年前から抗CCP抗体などの自己抗体が出現しており、症状の出現に先立って、免疫学的な異常が生じていると考えられている。その後、関節痛をきたす時期を経て、RAの発症に至ると考えられている(Smolen J, et al. Lancet. 2016など)。
2.臨床症状
- 関節炎:関節における腫脹、熱感、圧痛、発赤を確認する。
- 朝のこわばり:持続時間
- 関節変形の有無:Swan neck, ボタン穴、Z字変形、外反母趾など
- 皮膚:紫斑、潰瘍、リウマトイド結節(関節伸側、後頭部など)
- そのほかの関節外病変:間質性肺炎、アミロイドーシス、上強膜炎、神経障害など
- 全身症状:発熱、体重減少など。60歳以上で発症したRAをEORA(Elderly-onset RA)では、60歳未満で発症する患者と比較し、大関節炎を主体とし、発熱、体重減少を伴うことも多く、突然発症することもあるため、PMRとの鑑別が問題となる。
3.検査
- 関節破壊の_評価
- 単純X線写真位を反復して行えるが、検者による差がある。
- 造影MRI:滑:erosion, joint space narrowing(JSN), 変形の評価。頸椎病変の確認。研究目的ではmodified Sharp-van der Heijde score(mTSS)を計算する。JSNはHAQの低下と関連があるがerosionは明確でないとされる(Aleteha D, ARD 2011)。
- 関節エコー:gray scaleによる滑膜肥厚・関節液貯留所見, power dopplerによる血流測定。簡便なため多くの部膜炎、骨びらん、骨髄浮腫。骨髄浮腫は健常人でもみられる。
- 採血 炎症反応(CRP, ESR, フィブリノーゲン), RF, CCP2抗体, MMP3
- HAQ 質問紙
- VAS Dr-VAS, patient-VAS 5)
- 臓器合併症の評価
- 胸部〜骨盤CT、呼吸機能検査など、必要に応じて。
- 薬剤治療導入前の評価
- 間質性肺炎があれば画像評価、呼吸機能検査
- ウイルス肝炎:HBs抗原、HBc抗体、HBs抗体、HCV抗体
- 胸部CT(陳旧性肺結核r/o)
- ツベルクリン反応(T-SPOT)
- 悪性腫瘍鑑別のための上部・下部消化管内視鏡(ルーチンではない)
4.診断と活動性評価
1) 診断
2010年ACR/EULARによる分類基準を用いる。びらん性滑膜炎はRAと分類。びらんを有さない滑膜炎で、6点以上でRAと分類(Ann Rheum Dis.2010. 69;1580-88)。
| 腫脹または圧痛関節数 | 1個の中〜大関節 | 0 |
|---|---|---|
| 2〜10個の中〜大関節 | 1 | |
| 1〜3個の小関節 | 2 | |
| 4〜10個の小関節 | 3 | |
| 11個以上の大小問わない関節 (少なくとも1つは小関節) |
5 | |
| 血清学的検査 | RF, 抗CCP抗体 陰性 | 0 |
| RFか抗CCP抗体が低力価陽性 | 2 | |
| RFか抗CCP抗体が高力価陽性 | 3 | |
| 滑膜炎の期間 | 6週間未満 | 0 |
| 6週間以上 | 1 | |
| 急性期反応 | CRPもESRも正常値 | 0 |
| CRPかESRが異常値 | 1 |
参考:1987年のRA 分類基準(American Rheumatism Association: 現在のACR)。
感度 91-94%, 特異度 89%とされる。早期例での感度が低いものの、特異度は高いとされる。下記項目のうち4項目以上で分類される。
- 朝のこわばりが1時間以上持続する
- 3領域以上の関節炎:単なる骨の隆起ではなく、医師によって「軟部組織の腫脹」「関節液の貯留」として関節の炎症が確認されたもの
- 手関節、MCP関節、PIP関節の関節炎
- 対称性の関節炎
- リウマトイド結節:骨の突出部や関節伸側、関節の隣接部位・肺に存在する皮下結節
- リウマトイド因子陽性
- X線写真の異常:RAに典型的な変化(骨びらん、decalcification)が手のX線写真で認められる
- 項目 a-dについては6週間以上持続している
- 項目b-eについては医師による確認を要する
- 項目 a-dについては6週間以上持続している
2) RAの疾患活動性評価
RAの活動性は〔医師の診察所見〕+〔患者の自覚症状〕+〔臨床検査値〕を組み合わせたcomposite measureによって評価されるべきである。日常的に最も多く使用されるcomposite measureはDAS28で、手指・手・肘・肩・膝関節(計28個)について、腫脹・圧痛の有無を確認し、患者の「全般的健康度」を0-100mmのスケール(Visual analogue scale: VAS)で評価、それにESRもしくはCRPを追加して計算する
患者から評価した「全般的健康度」に加えて、医師から見た「患者の全般的健康度」も記載しておくと、CDAI(Clinical disease activity index), SDAI(Simple disease activity index)も計算可能となる。
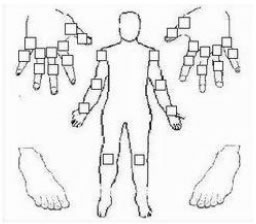
DAS28で使用される28関節の図
計算式
- DAS28-ESR=0.56×√(圧痛関節数+0.28×√(腫脹関節数+0.70×Ln(ESR)+0.014 × 患者による全般評価(VAS)
- DAS28-CRP=0.56×√(圧痛関節数+0.28×√(腫脹関節数+0.36×Ln(CRP x 10+1)+0.014 × 患者による全般評価(VAS)+0.96
- CDAI=圧痛関節数+腫脹関節数+患者による全般的評価(VAS)+医師による全般的評価(VAS)
- SDAI=圧痛関節数+腫脹関節数+患者による全般的評価(VAS)+医師による全般的評価(VAS)+CRP(mg/dL)
5.治療
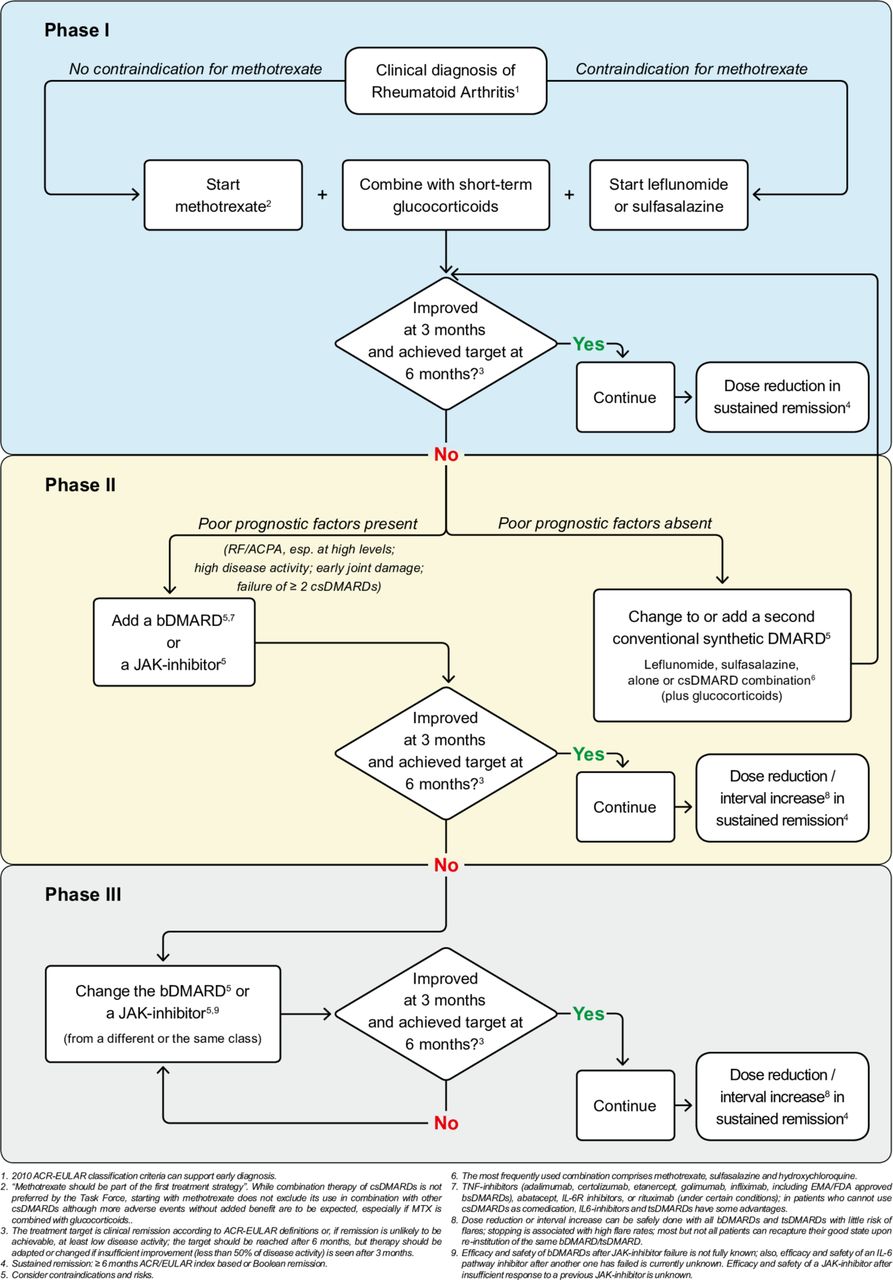
ヨーロッパリウマチ学会(EULAR)の関節リウマチ治療ガイドラインが2019年に改訂されている(Smolen JS. Ann Rheum Dis 2020;79:685-699.)。このプロトコルを参照しつつ、リスクに応じた治療導入と、少なくとも3か月ごとの疾患活動性評価を上記のcomposite measuresを用いて行う。寛解(remission)もしくは(合併症が多い場合や罹病期間が長い場合など)低疾患活動性を目標に治療を行うべきである。改善基準については治験ではACRコアセットが用いられてきたが、実臨床ではEULAR基準が参考になる。寛解については、DAS28-ESR<2.6, SDAI<3.3, CDAI<2.8, Boolean寛解基準(圧痛関節数≦1, 腫脹関節数≦1, 患者疾患活動性全般評価 VASで1cm以下, CRP≦1 mg/dl)の順に厳しい基準となり、2019年のEULARガイドラインではCDAI, SDAI寛解以上が目標とされるようになった。また寛解達成後の薬剤減量、中止についても考慮されるとあるが、使用している薬剤の特性に応じた対応が必要である。
Smolen JS. Ann Rheum Dis 2020;79:685-699より
EULARによるRA治療反応性の基準
DAS改善 |
|||
DAS28 at endpoint |
>1.2 |
0.6 – 1.2 |
< 0.6 |
<3.2 |
Good response |
Moderate response |
No response |
3.2 - 5.1 |
Moderate response |
Moderate response |
No response |
>5.1 |
Moderate response |
No response |
No response |
1)Conventional synthetic DMARDs (csDMARDS、従来型合成抗リウマチ薬)
ガイドライン上csDMARDsは、「メトトレキサート、サラゾスルファピリジン、レフルノミド、ヒドロキシクロロキン等」と記載されているが、本邦でよく使用されるcsDMARDsは、メトトレキサート、サラゾスルファピリジン、ブシラミン、タクロリムス、イグラチモドである。(日本人ではレフルノミドによる薬剤性肺障害のリスクが高いため、日本ではあまり使われない。また、ヒドロキシクロロキンは本邦では関節リウマチに保険適応がない。)
ガイドライン記載の通り、禁忌がない限り、まずはメトトレキサートを使用する
- Methotrexateの禁忌(JCRのMTXガイドラインより):妊婦もしくは妊娠している可能性やその計画のある患者、授乳中の患者、重症感染症を有する患者、重大な血液・リンパ系障害を有する患者(MDS・再生不良性貧血・赤芽球癆の既往、5年以内のリンパ増殖性疾患の既往、白血球<3000/mm3、血小板<5万/mm3)、肝障害を有する患者(B型またはC型の急性・慢性活動性ウイルス性肝炎を合併している場合、肝硬変と診断された場合)、eGFR<30ml/分/1.73m2以下に相当する腎障害を有する患者、高度な呼吸器障害を有する患者(室内気でPaO2<70mmHr、%VC<890%、画像上の高度のIP)
- Methotrexateの慎重投与:潜在性結核感染症が疑われる例(イソニアジドの投与を行う)、軽度の間質性肺炎、B型肝炎ウイルスキャリア・既往感染者(「免疫抑制・化学療法により発症するB型肝炎対策ガイドライン」など参照しつつ、HBV-DNAをモニター、消化器内科コンサルトを考慮)、C型肝炎ウイルスキャリア(消化器内科コンサルト)、eGFR<60 ml/分/1.73m2以下に相当する腎障害など
2)ステロイド・NSAIDs
- 抗リウマチ薬の効果発現までに早くとも数週間かかる:効果発現までbridgingとしてステロイド(内服、関節腔内注射)、NSAIDを用いる。
- ステロイドの使用に関して、現在のEULARのガイドライン上は、「csDMARDsを開始・変更する場合には、短期ステロイド併用を検討し、可能な限り速やかに漸減する」となっている。投与量・方法・漸減方法に関しては明確なコンセンサスはなく、PSL30mg-60mg/日から速やかに漸減する方法(COBRA Arthritis Rheum. 2002;46:347.やBeSt Study Arthritis Rheum. 2005;52:3381.、CareRA Ann Rheum Dis. 2017;76:511)やmPSL120mg単回筋注(tReach trial Ann Rheum Dis. 2014;73:1331.)などの投与方法も報告されているが、実際には少量の内服ステロイド(最大PSL7.5-10mg/日)±関節注射を使用していることが多い。ステロイドの併用に関しては、疾患活動性や合併症を踏まえて検討する。短期の併用による疾患活動性抑制や骨破壊抑制作用が期待されるが、心血管系リスク、骨粗鬆症等のステロイド副作用を考慮する必要がある。
3)生物学的製剤(bDMARDs)
- 本邦で使用できるのはinfliximab、etanercept、adalimumab、certolizumab pegol、golimumabなどのTNF阻害剤、tocilizumab(抗IL-6R抗体)、abatacept(CTLA-4Ig)。以上に加えて、IFX, ETN, ADAのバイオシミラーも上市されている。
- これらの薬剤は、RAの速やかな臨床的改善(ACR 20-50-70が約16週で60%-40%-20%)とともに、関節破壊の強力な抑制効果も示す。
- 現時点で、生物学的製剤にHead-to-headの比較試験はほとんどないが、下記を参照に薬剤の選択する
- 基本的にTNF阻害薬はメトトレキサートを併用した方が良好な効果が得られるため、可能であればメトトレキサートと併用する。メトトレキサートを併用できない症例ではIL-6阻害薬、高容量のTNF阻害薬(Golimumab 100mg)が考慮される。
- Abataceptは抗CCP抗体陽性例で有効性が高く、抗CCP抗体陰性例では、abatacept以外の製剤を優先する。
- 投与方法(点滴vs皮下注射、投与間隔)が製剤によって異なるため、その点も考慮する。
- 副作用について、感染症リスクは生物学的製剤間での差は「ほとんど」ないようだ(Pawar A. Lancet rheumatology. 2020;2:e84-e98)。
- Abataceptは比較的感染症のリスクが低いと考えられている。抗TNF製剤の中ではIFXが感染症のリスクが高いとされている(Ann Rheum Dis. 2015;74:1065)。
- IL-6阻害薬は、急性炎症反応を強力にマスクするため、感染症が起きてもCRPは上昇していない場合が見られる。患者の症状も比較的軽微でありながら重篤な感染症が起きた事例の報告もあり、注意(感染症発症の頻度自体は他の生物学的製剤と変わらないと報告されている)
- 導入前に
- 潜在性結核の評価
- 悪性腫瘍についてage-appropriate screeningがなされていること
- 心不全の有無(抗TNF製剤による心不全悪化の報告があるため、日本リウマチ学会のガイドラインではNYHA III度以上は抗TNF製剤投与の禁忌となっている。Abataceptとtocilizumabに関しては心不全患者でも使用可能。)
- 脱髄性疾患の家族歴がないこと
- また、導入前に、
- 肺炎球菌ワクチン
- インフルエンザワクチン(毎年)
を確認しておく必要がある。
潜在性結核について:CDCによるTNF阻害薬使用前の結核スクリーニングガイドラインでは、PPD硬結径 5mm以上を陽性としているが、本邦ではBCG接種のため解釈が困難なこともあり、しばしばケースバイケースの判断を余儀なくされる。
ツベルクリン反応(T-SPOT)、胸部CT(における陳旧性結核陰影)のいずれかが陽性であれば、イソニアジド(イスコチン)を5mg/kg(最大 300mg/day)開始、開始後3週間してから生物学的製剤を導入する。(入院時に潜在性結核感染が判明した場合には、その入院中には生物学的製剤は開始できない)
悪性腫瘍について、家族歴などのリスクを勘案の上、上部消化管内視鏡検査、下部消化管内視鏡検査(あるいは便潜血複数回陰性を確認)、腹部超音波検査、マンモグラフィー+超音波 などのスクリーニングを行う。これらは外来でなされていないことが多い。
心不全については無症状であるかどうかを確認の上、BNP基準値であれば問題ない。
の接種が望ましい
4) JAK阻害薬 (tsDMARD)
- サイトカインのシグナル伝達に重要であるJAK(Janus kinase)を阻害する経口薬剤である。試験によって差があるものの、どのJAK阻害薬でも単剤、MTX併用およびAdalimumabを対象として同等またはそれ以上の有効性が報告されており、2019年EULAR recommendationではphase 2での使用も提言されている。
- 本邦では、現在5種類(Tofacitinib, Baricitinib, Upadacitinib, Filgotinib, Peficitinib)が関節リウマチの治療薬として承認されている。JAK選択性、代謝等に違いがある。
- 日本人では帯状疱疹が多いため、投与前の帯状疱疹ワクチン投与などの対策を考慮する。
- 合併症として、感染症の他、低頻度であるが血栓塞栓症に注意が必要である。また悪性腫瘍についてもFDAから注意喚起がでている(2021/9月)。
5)Denosumab(抗RANKL抗体)
- 骨芽細胞などの膜表面に発現しているRANKLを阻害することにより破骨細胞の分化・誘導・骨吸収能力の抑制をもたらす。当初骨粗鬆症の治療薬として販売されたが、関節リウマチ患者において骨破壊抑制効果が報告されており(Arthritis Rheum. 008;58:1299)、関節リウマチの治療としても承認された
6.その他Topics
1)間質性肺炎合併関節リウマチ
- 本邦からの報告によると、間質性肺疾患182例中、男性が101例/742例(13.6%), 女性が81例/3478例(2.3%)と、男性に有意に多かった。
- 男性では間質性肺疾患と喫煙歴との関連が示唆された。
- また、気道病変のうち、「中葉舌区症候群」が246例に見られ、頻度は5.8%であった。
- 治療: 臨床的に有意な呼吸機能低下を認め、緩徐に進行する例、あるいは急速に進行する例では、免疫抑制治療を行う。中等量〜高用量のステロイドとともにCyclosporin A, Azathioprine, IV Cyclophosphamideを導入する。
2)MTX pneumonitis
- Alarconらの報告 “Risk Factors for Methotrexate-Induced Lung Injury in Patients with Rheumatoid Arthritis: A Multicenter, Case-Control Study” Annals of Internal Medicine 1997がしばしば引用される。以下に同報告の知見を箇条書きにする。
- MTX内服中のRA患者111例のRetrospectiveな検討。そのうち29例がMTX による肺障害を発症していた。
- 肺障害のPredictorとして、以下の5項目が同定された
Odds ratio |
95%信頼区間(CI) |
|
|---|---|---|
年齢 |
5.1 |
1.2-21.1 |
糖尿病 |
35.6 |
1.3-∞ |
リウマチ性肺疾患 |
7.1 |
1.1-45.4 |
MTX以外のDMARDs使用 |
5.6 |
1.2-27.0 |
低アルブミン血症 |
19.5 |
3.5-109.7 |
- “Reducing the risk of methotrexate pneumonitis in rheumatoid arthritis”
MTX pneumonitis発症のリスクを調べた6つのStudyのMeta-analysisの結果、RAの「既存肺病変 prior lung disease」のPooled odds ratioは7.5 (95%CI 3.6-15.8)となった。このことから、著者らは以下のようなStrategyを提唱している。
①呼吸機能検査でDLcoを測定する
②%DLcoが70%以上 → MTX使用可能と判断する
③%DLcoが70%以下 → 胸部X線写真・HRCTで評価
a) ILDあり → MTXの使用を避ける
b) ILDなし → MTX使用可能と判断する
呼吸機能の低下を伴うILDでは、MTX pneumonitis発症のRiskが増すだけではなく、肺予備能の低下から、発症時に重篤化しうるとの発想から、まずPFTsで評価している。
3)MTX関連リンパ増殖性疾患(MTX related lymphoproliferative disorders; MTX-LPD)
- MTX使用患者におけるリンパ増殖性疾患。殆どが自己免疫性疾患からの報告で、大部分が関節リウマチ症例。
- WHO分類では、免疫不全に伴うLPDの亜群の一つ(“Other iatrogenic immunodeficiency-associated lymphoproliferative disorders”)に分類される。
- B細胞型非ホジキンリンパ腫が多く、病理組織学的にはMTXの投与なしに発症したリンパ腫と区別はできないとされる。
- 発症機序の詳細は依然不明。MTXの投与による免疫抑制状態下で、ウイルス感染ないし不顕性感染ウイルスの再活性化が起こり、もともと疾患として特定クローンの自己反応性T,B細胞が存在しやすくなっているところで、細胞のクローナルな増殖を助長する可能性が推測されている。
- Epstein-Barr virus (EBV)の関連が注目されており、MTX-LPDの大部分でEBVの活性化があり、こうした症例ではMTX中止のみで寛解する可能性が高いことが報告されている。
- 中止のみで消退する可能性があることから、まずはMTXを中止し経過観察。中止後2週間経過しても症状の改善がない場合には、通常のリンパ腫として化学療法を考慮する。再発例も存在することから、長期フォローを要し、MTXの再投与は避けるべきとされる。
- MTX使用と関係なく、関節リウマチ患者では、悪性リンパ腫発症頻度一般人口と比較して2-4倍などと報告されており、特に活動性の高い患者でリスクが高い。
- MTXを使用した関節リウマチ患者において、MTX使用そのものはMTX-LPDとの相関はなく、高疾患活動性やLDHがLPDと相関するとの報告がある(Clin Rheumatol.2017;36:1237)。一方で、MTX使用量とMTX-LPDの発症の関連を示唆する報告もある(Arthritis Care Res (Hoboken). 2014 ;66:1302)。
4)Rheumatoid Vasculitis(悪性関節リウマチ)
- 関節リウマチを背景として、血管炎を発症することがあり、rheumatoid vasculitisと呼ばれる。通常小〜中型血管が侵されるが、大動脈炎の報告もある。Rheumatoid vasculitisは通常RF/ACPA陽性で関節リウマチの罹患歴が長く、高度の関節変形を有する患者に発症する。血液検査上は、炎症反応上昇に加え、RF強陽性、補体低下を認めることが多い。血管炎発症時には、関節炎の活動性は必ずしも高いとは限らない。症状としては、皮膚症状が最も多く、そのほか間質性肺炎、胸膜炎、末梢神経障害、眼症状(上強膜炎)、心膜炎などが多い。生物学的製剤の使用の増加に伴い、生物学的製剤による血管炎の報告も増えてきており、関節リウマチ患者が血管炎を発症した際には鑑別を要する(Curr Rheumatol Rep. 2016;18:39)。
5)Felty症候群
- 関節リウマチ、好中球減少、脾腫を3徴とする
- 通常RF/ACPA陽性で関節変形の強い関節リウマチ患者に発症し、関節リウマチ全般と比較して、関節外症状の合併が多い
- 好中球減少と、それに伴う細菌感染に対しては、通常の好中球減少時の感染に準じて対応を行う
- 症例報告、ケースシリーズレベルではMTXやRTXの有用性が示唆されているが、稀な疾患であるため良質なエビデンスは限られている
6)喫煙との関係
- 喫煙は、関節リウマチ発症のリスク因子であり、特にshared epitope陽性例において発症のリスクを高める(Curr Opin Rheumatol. 2009;21:279)
- Shared epitope: 関節リウマチのリスクとなるHLA-DRB1アリル(0101,0401, 0404, 0405等)において70-74番目のアミノ酸配列が共通しており、shared epitopeと呼ばれる
- 抗CCP抗体陽性例、特に抗CCP抗体の中でも抗CEP-1抗体、抗vimentin(Cit-vim)抗体陽性例との関連が示唆されている(Ann Rheum Dis. 2014;73:741)
- 喫煙関節リウマチ発症に関与する機序としては、喫煙が肺におけるシトルリン化蛋白の増加させる可能性などが報告されている(Curr Opin Rheumatol 2009;21:279)
7) Difficult-to-treat RA
治療困難な関節リウマチとして、EULARから"Difficult-to-treat (D2T) RA"の定義が提唱された(Nagy G. Ann Rheum Dis. 2021;80:31-35)。D2T RAの臨床像は単一ではなく、真の治療抵抗性例のほかにも、社会心理的な状況や合併症の影響などによる治療困難例が含まれていることに留意する。EULAR definition of difficult-to-treat RA(Nagy G. Ann Rheum Dis. 2021;80:31-35)
- EULAR recommendationに従い治療しているにもかかわらず、csDMARD治療のあと2剤以上のb/tsDMARDs (異なるmode of action)により治療されている
- 以下に定義されるうち、1つ以上の活動性・進行性疾患を示唆する徴候がある:
- 少なくとも中疾患活動性以上 (例えば DAS28-ESR>3.2 or CDAI>10).
- 活動性疾患の徴候(急性期反応、画像など)、疾患活動性を示唆する症状(関節ほか)が存在する.
- グルココルチコイドを減量できない (プレドニゾロン換算7.5 mg/day以下).
- (疾患活動性の有無にかかわらず)急な画像上の(骨破壊)進行がみられる.
- 上記の基準では疾患活動性が制御されているにもかかわらず、QOLの著しい低下を招くリウマチ関連の症状が残存している
- 少なくとも中疾患活動性以上 (例えば DAS28-ESR>3.2 or CDAI>10).
- 徴候・症状のマネジメントについて、リウマチ専門医・患者により解決が難しいと考えられている。
 東京大学医学部附属病院
東京大学医学部附属病院








