疾患解説
乾癬性関節炎 (Psoriatic Arthritis, PsA)
1.疾患概念と疫学
乾癬性関節炎(以下PsA)は炎症性角化症である乾癬(Psoriasis)と関連した炎症性関節炎である。乾癬の皮膚病変や爪病変に加えて、末梢関節炎、脊椎関節炎(spondyloarthritis, SpA)、腱付着部炎 (enthesitis)および指趾炎(dactylitis)など多様な臨床症状を呈する。これら炎症の主体は、腱や靭帯が骨に付着する部位に生じる付着部炎にある。PsAは、リウマトイド因子陰性脊椎関節炎の観点からSpAの一つで、ASAS (assessment of spodyloarthritis international society: 国際脊椎関節炎評価学会)の分類基準からは、末梢性(peripheral)SpAに含まれる。
PsAの有病率は、全世界的に乾癬の30%と報告されており、人種差が大きい。日本人のPsAは、乾癬の10-15%で、欧米人と比較し少ない。人口あたり、欧米人では0.1-0.2%に対し、日本人は0.01%で約10万人と推定される。好発年齢は30-50才で男女比は1:1である。日本人ではやや男性に多い。(Ritchlin CT et al: NEJM 376:957-70, 2017)(PsA診療ガイドライン2019: 日本皮膚科学会誌 129: 2675-733, 2019)
2.臨床症状
| 1) 末梢関節炎 (70%) | |
|---|---|
| 2) 脊椎関節炎 (30-50%) |
PsAの関節所見は、手指・足趾のDIP関節を主体とする末梢関節から膝・肩などの大関節、そして脊椎・仙腸関節まで幅広くみられる。古くはMoll&Wrightが提唱した以下5つの関節炎タイプ (表1) が知られているが、重複かつ移行する場合も多いことから、現在はあまり使われていない。現在は、ASASの基準に基づき、peripheral SpA、体軸型(axial) SpAという観点で捉えることが多く、PsAは70%に末梢関節炎を認めることから、peripheral SpAに含まれる。末梢関節炎は、朝や夜間、同じ姿勢で増悪し、運動にて軽快することが多い。脊椎関節炎も同様の出方をするため、炎症性腰痛として捉えられている。症状は、再燃と軽快を繰り返すことが多い一方、関節破壊が急速に進行し不可逆な傷害に陥る場合もある。これら関節炎症状は、乾癬皮疹出現後10年前後でみられることが多く、皮疹先行型が85%である。 |
| 3) 腱付着部炎 (30-50%) |
腱付着部である踵部、膝周囲、肘周囲、骨盤周囲に疼痛がみられる。部位別頻度は、多い順にアキレス腱付着部、 踵骨足底腱膜、上腕骨外上顆である。腱付着部炎の症状もまた、関節炎と同様に安静時に強い。 |
| 4) 指趾炎 (25%) | 指趾炎は屈筋の腱鞘炎である。発症早期の足趾のMP-DIP間の軟部組織の腫張として認められることが多い。同時にその部位の関節炎を伴うことも多い。 |
| 5) 爪病変 (80-90%) | 指趾周囲の側副靭帯や腱の付着するDIP関節付近に付着部炎が起き、爪母に炎症が波及することから生じる。爪甲剥離、点状陥凹、爪下角質増殖、油滴などを認める。 |
| 6) 皮疹 (90-95%) | 銀白色の鱗屑を伴った境界明瞭な紅斑で、肘・膝の伸側、頭皮、耳、仙骨上方に多いが、体のあらゆる部分で見られる。初期は小さいが、徐々に拡大・融合が見られるようになる。PsAのリスク因子として、頭部や殿部の皮疹、皮疹の広がりの程度が報告されている。 |
| 7) 上記以外の臓器障害 | 眼所見として、結膜炎、上強膜炎、ぶどう膜炎を認める。炎症性腸疾患を合併することがある。メタボリックシンドロームを併発することが多く、心血管へのリスクが高い。 |
| 病型 | 特徴 | 頻度 |
|---|---|---|
| 遠位関節型 | DIPが主体 | 10% |
| 非対称性少関節炎型 | 罹患関節4か所以下 | 30〜50% |
| 対称性多発関節炎型 | RAと類似、罹患関節5か所以上 | 30〜50% |
| 脊椎関節症 | 脊椎炎、仙腸関節炎 | 5〜30% |
| ムチランス型関節炎 | 手指関節の著明な破壊による指の短縮やオペラグラス様の変形 | まれ |
3.検査
1) 血液検査
PsAに診断的価値の高い検査はない。RF陰性、ACPA陰性は、診断上重要である。CRP, ESRなどの炎症反応上昇、MMP-3の上昇を認めることが多い。
2) 画像検査
| 1. 骨Xp | 両手指、両足趾、足側面像(腱付着部評価)、頚椎2方向、胸椎側面像、腰椎2方向、仙腸関節 → 末梢関節炎:pencil-in-cup、びらん、骨膜反応、特にDIPに多い 脊椎関節炎:syndesmophytes, squaring, 進行例で強直 仙腸関節炎:特に滑膜のある前部・下位1/2〜1/3での骨びらん、硬化 アキレス腱付着部〜踵〜足底部:腱付着部の石灰化 指趾炎 :軟部組織の腫張 |
|---|---|
| 2. MRI | 末梢関節炎、腱鞘炎、脊椎関節炎・仙腸関節炎 → 末梢関節炎:造影MRIにて炎症部位を判別 脊椎関節炎:腰椎および仙腸関節のT1&STIRの条件で炎症を判断 |
| 3. CT(必要時) | 脊椎関節炎・仙腸関節炎 →非造影CTにて硬化像の程度、広がりを描出 |
| 4. エコー | 末梢関節炎、腱付着部炎 →滑膜炎、腱鞘炎、腱付着部炎、爪病変を判別 |
4.診断と活動性評価
乾癬性関節炎の分類基準(CASPAR criteria (2006))(表2)を用いる。RA, OA, gout, ASなど、鑑別する (表3)。
疾患活動性評価指標は以下を用いる。
- 皮膚:PASI(Psoriasis Area and Severity Index)
- 腱付着部:Leeds enthesitis count(0-6)
- 指趾炎:tender dactylitis count(0-20)
- 末梢関節:疼痛関節(0-68), 腫脹関節(0-66), PtVAS, PtGAS, DrGAS
→DAS 28 (Disease Activity Score), DAS 66/68 - 脊椎関節: (評価詳細はASの項を参照)
- BASDAI (Bath Ankylosing Spondylitis Disease Activity Index)
- BASFI (Bath Ankylosing Spondylitis Functional Index)
- BASMI (Bath Ankylosing Spondylitis Metrology Index)
- ASDAS (Ankylosing Spondylitis Disease Activity Score)
- PsA composite mesure:
- CPDAI (Composite Psoriatic Disease Activity Index)
→末梢関節、体軸、皮膚、指炎、腱付着部炎 - PSDAS (Psoriatic Arthritis Disease Activity Score)
→末梢、指炎、腱付着部炎 - DAPSA (Disease Activity Index for PsA)
→末梢関節評価
- CPDAI (Composite Psoriatic Disease Activity Index)
- 機能評価/QOL、
- HAQ (Health Assessment Questionnaire)
- SF-36 (Short-Form 36-Item Health Survey)
- DLQI (Dermatology Life Quality Index)
| 必須項目 末梢関節炎、脊椎関節症または腱付着部炎の存在 必須項目があり、 以下5項目で3点(3項目ではない)以上あればPsAと診断 |
①現在の乾癬 | 2点 |
|---|---|---|
| 乾癬の既往 | 1点 | |
| 乾癬の家族歴 | 1点 | |
| ②爪病変の存在(陥凹、剥離) | 1点 | |
| ③指炎 | 1点 | |
| ④リウマトイド因子陰性 | 1点 | |
| ⑤(手・足)レントゲンで関節周囲の骨増殖像 | 1点 |
*CASPAR(2006年)以前に提案されたPsAの診断基準はない。
|
PsA
|
RA
|
Gout
|
OA
|
|
|---|---|---|---|---|
| 発症時罹患関節 | 非対称 | 左右対称 | 非対称 | 非対称 |
| 罹患関節痛 | 少 (2-4) | 多 | 単 or 少 | 単 or 少 |
| 指趾の罹患部位 | 遠位 | 近位 | 遠位 | 遠位 |
| 罹患関節 | 1本の指の全ての関節 | 全ての指趾 | 単関節 | 全ての指趾 |
| 圧痛誘発の強さ (kg/cm2) | 7 | 4 | NA | NA |
| 関節表面の紫色変化 | 有 | 無 | 有 | 無 |
| 脊椎病変 | 多い | 稀 | 無 | 非炎症性の変性 |
| 仙腸関節炎 | 多い | 無 | 無 | 無 |
5.治療
PsA治療ガイドラインが、以下から提示されている。
- GRAPPA : Coates LC et al: A&R: 68:1060-71, 2016
- EULAR : Gossec L et al: ARD 75:499-510, 2016
- ACR :Singh JA: ACR 71: 2-19,2019
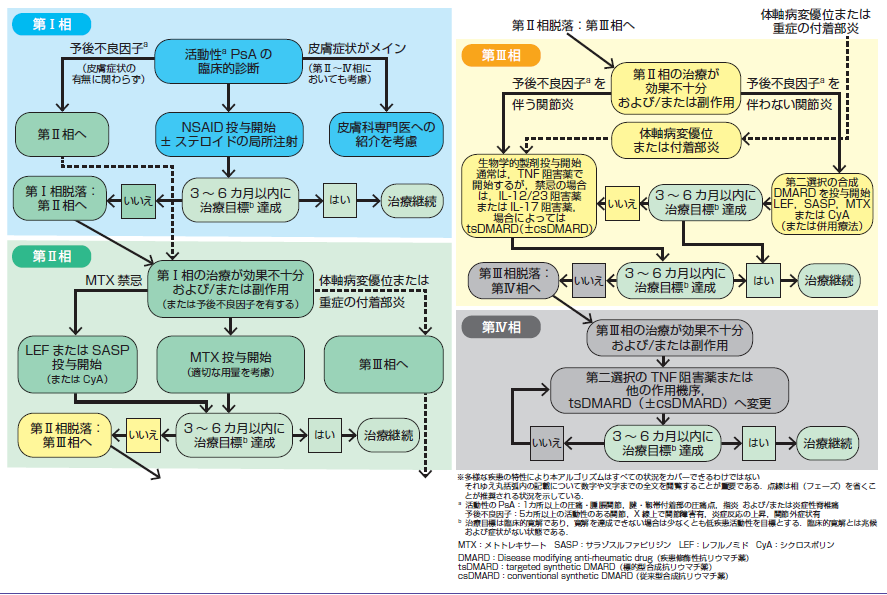
GRAPPAによる治療ガイドライン (図1) が障害部位ごとに治療推奨が記載されているため、日常診療では利用しやすい。複数病変持つ場合は、より強い治療を必要とする病変のフローチャートを優先させる。効果判定を3-6ヶ月毎行い、低疾患活動性を維持するように治療方針を見直し (図2) 、最小疾患活動性(MDA: minimal disease activity) (表4) を目標とする。日本では、2019年、日本皮膚科学会から「PsA診療ガイドライン」が発表された。簡単に各種薬剤の病変部位に対する効果を (表5) に示す。
| 1) NSAIDs | 症状の軽減目的に用いられる第1選択薬。消化管潰瘍のリスクや既往のある患者、長期投与が見込まれる患者では、COX-2阻害薬を考慮する。 |
|---|---|
| 2) ステロイド | 内服治療は推奨されないが、関節注射は、少数の末梢関節炎に対し、乾癬皮疹を避けて施行することが推奨されている。腱付着部への注射は、腱断裂のリスクや十分な有効性を示すデータないため、施行はさける。 |
| 3) 低分子DMARDs | 投与量はいずれもRAに準ずる
|
| 4) 生物学的製剤 (表6) | →予後不良因子を持ち (図2)、疾患活動性が高い (図2および各種評価項目にて) 場合、開始する。末梢だけでなく脊椎関節、腱付着部炎も含め、優先順位はTNF阻害剤、IL-17阻害剤、IL-12/23阻害剤である。 |
| 5) 理学療法 | |
| 6) ダイエット | →PsAはメタボリックシンドロームや、心血管疾患等の合併が多いため、必要である。疾患活動性のコントロールにもなる。 |
表4. GRAPPが提唱するMDA

| 末梢関節炎 | 皮膚 | 脊椎・仙腸関節炎 | 腱付着部炎・指炎 | |
|---|---|---|---|---|
| NSAIDs | ○ | ○ | ||
| ステロイド | △ * | 外用のみ○ | ||
| SASP | ( ○ ) | ( ○ ) | ||
| MTX | ○ | ○ | ||
| CsA | ○ | ○ | ||
| 生物製剤 | ○ | ○ | ○ ** | ○ |
( ○ ):保険適応なし
* △: 適応は限定的であり、慎重に考慮する必要がある
** 長期的な靭帯骨化、骨増殖抑制への有効性についての結論は出ていない
表6.日本で投与可能な生物学的製剤 .
| 薬剤 (一般名) | 薬剤 (商品名) | 日本での 承認年 |
投与方法 | |
|---|---|---|---|---|
| Anti-TNF | Infliximab | レミケード® | 2010 | 5mg/kgを点滴静注、0,2,6週、以降8週間隔 |
| Adalimumab | ヒュミラ® | 2010 | 初回 80mg皮下注、以後40mg皮下注を2週間隔, 80mg まで増量可能 | |
| certolizumab pegol | シムジア® | 2019 | 400mg皮下注を0,2,4週、以後200mg 2週間隔あるいは400mg 4週間隔 | |
| Anti-IL12/ IL23 p40 |
Ustekinumab | ステラーラ® | 2011 | 45mg皮下注を0,4週、以降12週間隔 , 90mg まで増量可 |
| Anti-IL-23 p19 | Guselkumab | トレムフィア® | 2018 | 100mg皮下注を0,4週、以降8週間隔 |
| Risankizumab | スキリージ® | 2019 | 150mg皮下注を0,4週、以降12週間隔 | |
| Anti-IL17 | Secukinumab (anti-IL17A) | コセンティクス® | 2015 | 300mg皮下注を0,1,2,3,4週、以降4週間隔 |
| Ixekizumab(anti-IL-17A) | トルツ® | 2016 | 初回160mg 皮下注、以後2-12週までは80mgを2週間隔、以後は80mgを4週間隔、ただし20週までは2週間隔可 | |
| Brodalumab(anti-IL-17AR) | ルミセフ® | 2016 | 210mg皮下注、0,1,2週、以降2週間隔 |
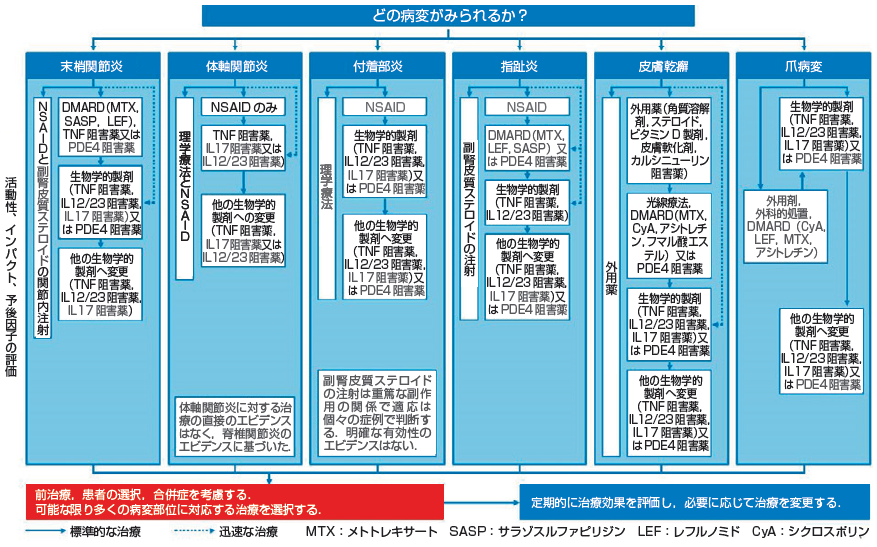
図1. GRAPPAによるPsA治療ガイドライン (日本皮膚科学会「PsA診療ガイドライン」より)
図2. EULARによるPsA治療ガイドライン((日本皮膚科学会「PsA診療ガイドライン」より)
 東京大学医学部附属病院
東京大学医学部附属病院