疾患解説
全身性硬化症(強皮症)(Systemic Sclerosis)
1. 疾患概念と疫学
強皮症(systemic sclerosis, SSc)は皮膚硬化を特徴とする原因不明の自己免疫疾患である。全身の小血管の閉塞、免疫系の活性化、皮膚および臓器の線維化を基本病理とし、皮膚の他に腎・肺・消化管・心循環系が侵される。皮膚硬化の分布によりlimited cutaneous SSc(四肢末梢と顔面のみ)、diffuse cutaneous SSc(体幹部を含む)の2つの型に分けられる(LeRoy and Medsgerの分類)。まれに皮膚硬化を伴わないsine sclerodermaの型もみられる。limited cutaneous SScの中で石灰化(Calcification)、レイノー現象(Raynaud’s phenomenon)、食道病変(Esophageal involvement)、末端皮膚硬化(Sclerodactyly)、毛細血管拡張(Telangiectasia)を伴う場合にCREST症候群と呼ぶ。
強皮症病型分類 (LeRoyとMedsgerによる、一部改変)
| Diffuse cutaneous | SScLimited cutaneous SSc | |
|---|---|---|
| 皮膚硬化 | 肘関節より近位皮膚硬化 | 肘関節より遠位皮膚硬化 |
| 進行 | 急速(皮膚硬化出現2年以内) | 緩徐(皮膚硬化出現5年以上) |
| Raynaud現象と皮膚硬化 | 皮膚硬化が先行するかほぼ同時 | Raynaud現象が先行 |
| 毛細管顕微鏡所見 | 毛細血管の脱落 | 毛細血管の蛇行,拡張 |
| 爪上皮内出血点 | 進行期には消失 | 多数 |
| 腱摩擦音 | 腱摩擦音(+)(日本人では少ない) | 腱摩擦音(-) |
| 関節拘縮 | 高度 | 軽度 |
| 石灰沈着 | まれ | 多い |
| 主要臓器病変 | 肺,腎,心,食道 | 肺高血圧症,食道 |
| 主要抗核抗体 | 抗トポイソメラーゼI抗体 抗RNAポリメラーゼ抗体 |
抗セントロメア抗体 |
好発年齢は50-60歳代、男女比は1:7で女性に多い。有病率は人口10万人あたり10人。初診後10年の生存率は50-65%との報告があり、肺高血圧症、肺線維症や腸管の吸収不良が主要な死因となる。
2. 臨床症状
1)皮膚:硬化:分布(末梢型、全身体幹型)、進展の速さ、浮腫期→硬化期→委縮期
皮膚硬化のスコアリング:modified Rodnan total skin thickness score (TSS)
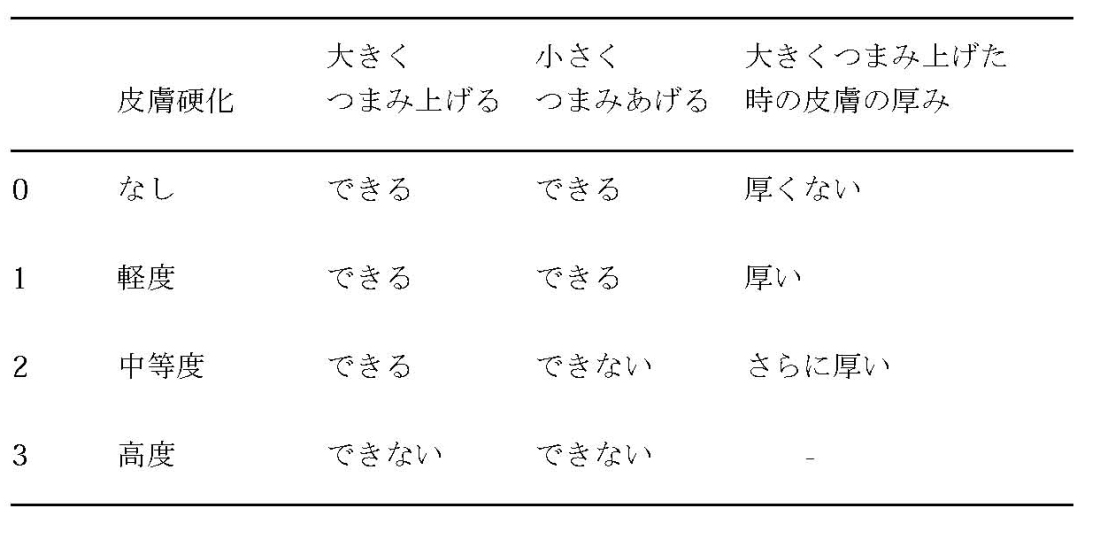
手指ではPIPとMP関節の間で調べる。腫脹時には評価に注意が必要。
以下の17の部位でそれぞれ皮膚硬化の程度をスコア化し、その合計をスキンスコアとする。
2)体重変化:発症からの体重減少は重症度の指標となる。
3)末梢循環障害:レイノー症状 (limited SSc-発症に数年先行、diffuse SSc-発症と同時が多い)、指尖潰瘍・pitting scar、爪上皮出血、爪上皮延長
Capillaroscopyによる爪根部毛細血管の巨大化、途絶、微小出血および血管新生の存在はSScを示唆する。
4)皮膚所見:Telangiectasia(Rendu-Osler-Weber型, くも状血管腫型)、石灰化(手指、上下肢伸側)、脱毛(被髪頭部皮膚硬化)、色素沈着、脱失
5)開口障害、舌小帯短縮
6)筋・関節
- 関節炎様症状(関節痛、指の腫脹)RA様の関節炎を呈することが多いが、OAに類似したDIP関節の変化も伴うことが多い
- 筋症状 軽度の近位筋の筋力低下(線維化に伴う)
7)呼吸器症状:労作時呼吸困難、咳、痰
8)胸部聴診:肺線維症があると、fine crackle聴取、肺高血圧では胸骨領域の拍動、II音の亢進、肺動脈弁・三尖弁領域の逆流
9)消化器症状:嚥下困難、嚥下痛、胃食道逆流、便秘・吸収障害・下痢、腸管からの出血(腸管の拡張血管からの出血)
3. 検査
1)採血:血算・生化
- 貧血 (溶血, 慢性炎症, 鉄欠乏, 腎性など様々 破砕赤血球に要注意、ハプトグロビン測定)
- 血小板減少症 (腎クリーゼの初期に減少がみられる)・ BUN/Cre
- 炎症反応 CRP、ESR
- CPK
- BNP, NT-proBNP: PAH, 心筋障害の鑑別
- 間質性肺炎マーカー: KL-6、SPD
2)各種抗体陽性
- ANA陽性 (160倍以上を有意とする) ・抗Scl-70抗体陽性
- 抗 セントロメア抗体陽性 :CREST症候群との関連
- 抗RNP抗体陽性
- 抗RNAポリメラーゼIII抗体陽性:腎クリーゼのリスク
- MPO-ANCA/PR3-ANCA陽性 (正常血圧腎クリーゼなど)
4) 各種生理・画像検査
- 手関節レントゲン:指尖吸収
- 心電図、長時間心電図
- 心エコー
- 呼吸機能検査(VC, DLCOを含む)
肺高血圧と肺線維症を併発している場合(安静時平均肺動脈圧>25mmHg)、呼吸機能検査の値でFVC%/DLCO%比を参考に成分を評価する。
FVC%/DLCO%比>1.8(さらにFVC%>80)ならPAHの要素が強い
FVC%/DLCO%比<1.4(さらにFVC%<80)なら肺線維症の要素が強い
FVC%/DLCO%比1.4-1.8(さらにFVC%<80)なら肺線維症とPAHの混合と判断する - 胸部CT
- 食道造影、上下部内視鏡
4. 診断
診断については、2013年 米国/欧州リウマチ学会 強皮症分類基準を参考にする。
| 項目 ※9点以上で全身性硬化症と分類する | スコア |
|---|---|
| 1.両手指のMCP関節より近位の皮膚硬化 | 9 |
| 2.手指の皮膚硬化:腫れぼったい指(2点)、PIPからMCPまでの皮膚硬化(4点) ※点数の高い方をカウントする |
2-4 |
| 3.指尖部病変:指尖部潰瘍(2点)、指尖部陥凹性瘢痕(3点) ※高い方をカウント |
2-3 |
| 4.毛細血管拡張症 | 2 |
| 5.爪郭部の毛細血管異常 | 2 |
| 6.肺動脈性肺高血圧症 and/or 間質性肺疾患(Interstitial pneumonia : IP) | 2 |
| 7.レイノー現象 | 3 |
| 8.抗セントロメア抗体、抗トポイソメラーゼI(Scl70)抗体、抗RNAポリメラーゼIII抗体のいずれかが陽性 | 3 |
※皮膚硬化のない場合、類似する疾患(腎性全身性線維症、全身性斑状強皮症、好酸球性筋膜炎、糖尿病性浮腫性硬化症、硬化性粘液水腫、紅痛症、ポルフィリン症、硬化性苔癬、GVHD、糖尿病性手関節症など)には適応しない
※上記は「診断」基準ではなく、主に臨床研究のための「分類」基準であることに注意
※厚生労働省による日本独自の診断基準も存在する
全身性強皮症診断基準2003(厚生労働省)
大基準 手指あるいは足趾を越える皮膚硬化*
小基準
1) 手指あるいは足趾に限局する皮膚硬化
2) 手指尖端の陥凹性瘢痕、あるいは手指の萎縮**
3) 両側性肺基底部の線維症
4) 抗トポイソメラーゼI (Scl70)抗体または抗セントロメア抗体陽性
大基準あるいは小基準1)及び2)-4)の1項目以上を満たせば全身性強皮症と診断
* 限局性強皮症(いわゆるモルフィア)を除外する
** 手指の循環障害によるもので、外傷などによるものを除く
5. 治療・臓器別各論
総合的な内容についてはEULAR recommendation (2017)参照。(Kowal-Bielecka O, et al. ARD. 2017. 76:1327)
1) 皮膚硬化
皮膚硬化出現6年以内で、浮腫性硬化を主体とした急速な(数か月〜1年以内)皮膚硬化進行例に対しては浮腫期であればステロイド(初期量PSL20~30mg)の投与を検討する。ステロイドは強皮症腎クリーゼを誘発する可能性が指摘されており、投与時は注意が必要である。メトトレキサートは皮膚硬化に対し有効であったという報告があるが、間質性肺炎の合併例が多い強皮症では積極的には使用されない。
IL-6阻害療法であるトシリズマブの皮膚硬化への有効性は治験では証明できなかった。DESIRES研究により、リツキシマブの24週における皮膚硬化改善効果が証明され、2021年9月より保険収載された(Ebata S. Lancet Rheumatol. 2021;3:E489-497)。
その他、JAK阻害薬、アバタセプト、同種骨髄移植などの有効性が報告されている。
皮膚硬化の鑑別診断として好酸球性筋膜炎や中毒性油脂症toxic oil syndromeによる皮膚硬化が挙げられる。好酸球性筋膜炎は、激しい運動後などに好酸球増多を伴う非対称性の四肢の皮膚硬化をきたす疾患であり、通常顔面と手指は侵されない。MRIや生検で筋膜肥厚を確認し、ステロイドで治療する。
2)間質性肺炎
- 間質性肺炎が積極的な治療対象になりうるかの判断は、症状の変化/進行速度、炎症反応(赤沈、CRP)、LDH, 血ガスの悪化速度、呼吸機能検査の悪化速度、CT上の特徴的所見(スリガラス影、網状結節影)及びその変化速度で見る。1年間でのDLCOの15%以上の低下、FVCの10%以上の低下は予後不良を示唆する。
- HRCTでの病変が20%以下、FVC>70%をLimited disease、病変が20%以上、FVC<70%をExtensive diseaseと定義する(JCR 膠原病に伴う間質性肺炎診断治療指針2020)。
- 全例で禁煙を指導する。
- 活動性の間質性肺炎/肺胞炎/肺線維症がある場合には、高用量ステロイドの有効性は疑わしく、中等量以下のステロイド、免疫抑制剤(シクロホスファミド、MMF等)の適応がある(N Engl J Med 354;2655,2006; A&R 54:3962,2006)。間質性肺炎の進行を抑制するエビデンスがあるのは経口シクロホスファミド(POCY)であるが、相対的な副作用の少なさからシクロホスファミドパルス療法(IVCY)を行うことが多い。ミコフェノール酸モフェチル(MMF)の有効性についても報告があり(Lancet Respir Med. 2016 4(9): 708-19)、シクロホスファミドの代替薬もしくはシクロホスファミド使用後の維持療法としてのMMFを選択する機会が増えている。
- IL-6阻害薬であるトシリズマブのPhase 3治験(Khanna D. lancet Resp Med. 2021;8:963-974)において、48週におけるトシリズマブ投与群の%FVC distributionはプラセボより有意に改善することが示されている。
- メタアナリシスによればリツキシマブもILDに対して有効であると報告されている(Goswami RP. Rheumatology. 2020;60:557-567.)。
- 抗線維化薬ニンテタニブはSSc-ILDに対する%FVC低下抑制を認め、慢性進行性の症例への使用が考慮される(Distler O. NEJM. 2019;380:2518-2528)。下痢などの発現に注意する。
- HSCTについてもエビデンスがあり、リスクベネフィットを考慮して急速進行例、重症例については考慮される。
3)肺高血圧
- SSc-PAHはニース分類1群の肺血管性によるものが主であるが、1’群の肺静脈性、2群の心筋障害、3群の肺線維症による病態の混在が考えられるため、症例ごとの検討が必要である。
- 肺血管性の場合には血管拡張剤(経口プロスタグランジン製剤(ベラプロストナトリウム[商品名ドルナー、ケアロード(徐放剤)])、選択的PDE-5阻害薬(タダラフィル[商品名アドシルカ]、シルデナフィル[商品名レバチオ])、エンドセリン受容体拮抗薬(マシセンタン[商品名オプスミット], ボセンタン[商品名トラクリア]、アンブリセンタン[商品名ヴォルブリス])、可溶性グアニル酸シクラーゼ(sGC)刺激剤(リオシグアト[商品名アデムパス])、PGI2持続点滴療法(エポプロステロールナトリウム[商品名フローラン]))が、WHOによる肺高血圧機能分類のクラス(NYHA心機能分類と同じ)に基づいて、単剤または併用で開始されるが、循環器内科との併診が必要である。ワーファリンによる抗凝固療法はルーチンではすすめられず、血栓性素因のある患者にのみ行う(Eur Heart J 2016; 37: 67-119)。
4)末梢循環障害、指尖潰瘍
末梢循環不全による指尖潰瘍に対しては、PDE-5阻害薬は皮膚潰瘍の治癒を促進することがRCTのメタアナリシスで証明されている。またsmall scaleのRCTによれば、PDE5阻害薬は指尖潰瘍の予防にも有効な可能性がある。
ボセンタンは指尖潰瘍の新規発生数を減らすことがRCTで証明されており、カルシウム拮抗薬、PDE5阻害薬などの使用下でも指尖潰瘍が多発する症例で使用が考慮されるべきである。
イロプロスト静脈注射による指尖潰瘍の改善もRCTで有効であることが示されている。
5)腎・血圧
- 強皮症に合併する腎障害は大きく
- 強皮症腎クリーゼ(±TTP様の血栓性微小血管症)
- ANCA関連糸球体腎炎
に分けられる。 - 強皮症腎クリーゼの定義は、強皮症経過中の新出の急激な動脈性高血圧または急速進行性の乏尿性腎不全である。病態は弓状動脈や葉間動脈レベルのび慢性の内腔狭小化(Am J Pathol 91:243,1978) 、およびより細い血管のvasculopathyによる、高レニン性腎性高血圧/進行性腎不全/TTP様の微小血管溶血性貧血である。我が国における頻度はSScの数%とされている。
- 強皮症腎クリーゼのリスク要因は、広範な皮膚硬化、皮膚病変の急速な進行、発症4年以内、抗RNAポリメラーゼIII抗体陽性、新出の貧血、新出の心嚢水または心不全、先行する高用量ステロイド、である。
- 腎クリーゼの診断に際して重要な項目は以下の通りである。
- 拡張期血圧110mmHg以上の高血圧の出現
- 頭痛、痙攣発作、高血圧性眼底所見(K-W分類III以上)
- 血漿レニン活性の上昇、BUN, Creの上昇
- 蛋白尿、血尿の出現
- 抗RNAポリメラーゼIII抗体
- さらに、強皮症腎クリーゼの45%にみられるとされる微小血管性溶血性貧血(Ann Intern Med 133:600,2000)の有無の確認(溶血性貧血(Reti, LDH, Bil上昇、ハプトグロビン低下)、破砕赤血球、消費性血小板減少(DICの除外)、ADAMTS13活性の測定)は有用な情報となる。腎内血管の閉塞による急性尿細管壊死が主体で早期から高血圧をきたす狭義の強皮症腎クリーゼに相当する病態と、先行して血小板とハプトグロビンが低下しやや緩徐に血圧が上昇する血栓性微小血管症が優位な病態があるという意見もある。また近年ANCA陽性で糸球体腎炎を呈する病型が報告されており、従来正常血圧腎クリーゼと呼ばれていたものに相当する。この型では肺胞出血の報告が多く注意が必要である。
- 総合的に疑われる場合には、血中レニン活性を測定後(覚醒時起床前を原則とするが、緊急の場合には30分安静後の測定でも良い)ACE-Iによる血圧コントロールを開始する(Ann Intern Med 113:352,1990)。具体的には短時間作用型のカプトリル12.5-25mgを食前または食間に開始し1-2時間後の血圧を測定、SBP170-150を目標に6-8時間ごとのカプトリル内服量を増量する。カプトリル150m3xまでは増量し48-72時間以内に血圧を安定させる。ACEIだけで調節困難な場合には亜硝酸薬のほか、ニフェジピンなどのCa拮抗薬やアンギオテンシンII受容体阻害薬を併用する。腎不全が進行する場合には早期の血液透析導入を考慮する。透析に陥ってもACEIを併用し、数週から数年のインターバルで腎機能の回復がありうる。TTP様の要素が疑われる場合には血漿交換も検討する。
- ANCA関連糸球体腎炎では可能であれば腎生検を施行し、血管炎に準じて治療を行う。
6)消化管
対症療法が基本となり、逆流性食道炎に対してはプロトンポンプ阻害薬を使用する。蠕動不良によるbacterial overgrowthが関与している可能性がある場合には、長期の抗生剤サイクル療法(エリスロマイシン、カナマイシン、ニューキノロンなど)も考慮される。蠕動改善薬の使用も検討する。吸収不良症候群が疑われる場合には栄養吸収試験法も考慮する。偽牲腸閉塞、腸管嚢腫様気腫症による気腹などにより栄養状態が高度に低下する場合には、在宅中心静脈栄養が必要な場合もある。
7)心臓
- 強皮症に生ずる心不全の原因としては肺高血圧とそれに伴う右心不全が挙げられるが、他に心筋の線維化による心筋障害がある。臨床的には心筋障害の頻度は20-30%とされているが、剖検例では50-70%との報告がある。
- 明らかな冠動脈疾患の無い心不全であれば心筋線維化を評価するために心筋MRIによる評価を行う(Ann Rheum Dis 68:1878,2009)。不整脈がある場合、心臓ペースメーカーの適応になりうる。
2021年
 東京大学医学部附属病院
東京大学医学部附属病院








